6月19日,官方正式公布,CFDA加入ICH,成为其全球第8个监管机构成员。
新的标准、新的消费者、新的布局,未来行业一定会发生变化,大幕刚刚拉开,咱们有必要了解一下ICH。
ICH原中文名:人用药品注册技术要求国际协调会,现已更名:人用药品技术要求国际协调理事会,简称ICH(国际协调理事会)。
1.ICH的历史
20世纪80年代,欧洲成立欧共体,要求各成员国药品能在整个欧洲市场销售,因此在欧洲首先开展了药品注册技术要求的协调工作,实践证明是可行的。此后,美、日、欧共体三方纷纷进行双边对话,研讨协调的可能性,直至1989年在巴黎召开的国家药品管理当局国际会议(ICDRA)后,才开始制订具体实施计划。此后三方政府注册部门与国际制药工业协会联合会(IFPMA)联系,讨论由注册部门和工业部门共同发起国际协调会议可能性。1990年4月欧洲制药工业联合会(EFPIA)在布鲁塞尔召开由三方注册部门和工业部门参加的国际会议,讨论了ICH意义和任务,成立了ICH指导委员会。
ICH于1991年召开第一届会议。该会议由欧盟、美国及日本发起,并由三方成员国的药物管理当局以及制药企业管理协会共同组成。世界卫生组织各成员国以及加拿大和瑞士等国家以观察员身份参加会议,亦开始遵循ICH GCP准则,便于这些国家和地区的卫生管理当局能最终相互接受各自临床数据用于人用药物的注册。
ICH的目的是协调各国的药物注册技术要求(包括统一标准、检测要求、数据收集及报告格式),使药物生产厂家能够应用统一的注册资料规范,按照ICH的有效性、质量、安全性及综合学科指南申报。如果最终达成ICH目标,制药企业可以在世界各国同时上市其产品,不但提高申报注册资料的质量,同时可以缩短研发时间,节省研发成本,进而提高新药研发、注册、上市的效率。
2017年6月19日,中国国家食品药品监督管理总局(CFDA)成为ICH正式成员。

2、ICH的改革与更名
在成功运作25年后,为了更好地应对全球药品监管和行业发展的巨大变化和挑战,特别是要强化监管机构在国际法规协调方面的主导作用,ICH在2015年10月23日召开大会宣布对ICH进行改革,并更名为The International Council for Harmonisation(国际协调理事会)。此项改革将在25年来已形成的全球医药开发和监管的协调指导原则的基础上,继续加强发挥ICH的协调作用,以更好的应对全球医药开发和监管的挑战。ICH将吸纳全世界更多的监管机构参与其中,并融合所有重要的监管机构和业界相关方,以促使其成为全球药品监管协调的关键平台。此次改革的另一个重要内容是通过在瑞士设立ICH理事会的合法实体,以保证其运作模式更加稳定和规范。
3、ICH的组成

4、ICH指导原则的制订实施程序
步骤1. 取得共识:专家工作组基于概念文件起草技术文件草稿,在专家组内取得一致意见。
↓↓
步骤2. 共识确认:全体大会对技术文件共识进行确认,形成技术文件终稿,并基于此起草和形成指导原则草案。
↓↓
步骤3. 评议讨论:指导原则草案交予监管机构和工业界协会成员进行征求意见,专家工作组对意见进行讨论,达成一致并签署同意后,报送全体大会。
↓↓
步骤4. 最终采纳:全体大会与管理委员会协商后采纳指导原则,然后ICH各个监管机构成员采纳该指导原则。
↓↓
步骤5. 发布实施:根据各国家、地区的程序,批准的ICH指导原则在成员国分别发布实施。
ICH指导原则
质量(Q):包括稳定性、验证、杂质、规格等;
安全性(S):包括药理、毒理、药代等;
有效性(E):包括临床试验中的设计、研究报告、GCP等;
多学科类(M):包括术语、电子代码、共同技术文件、药学词典等。
Q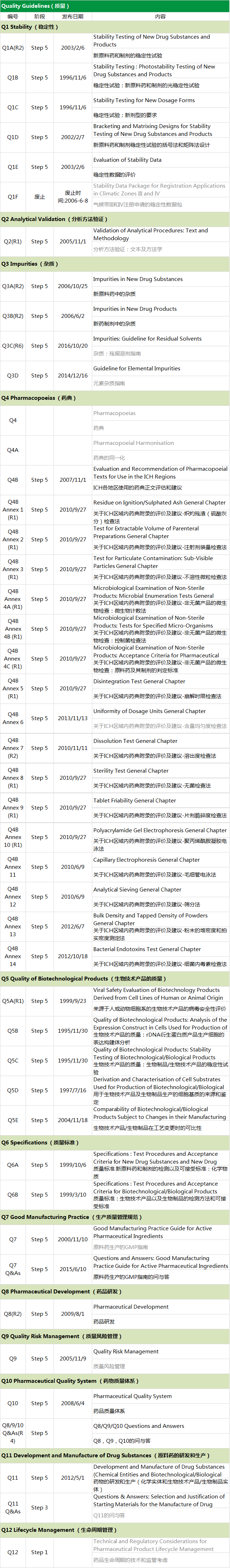
S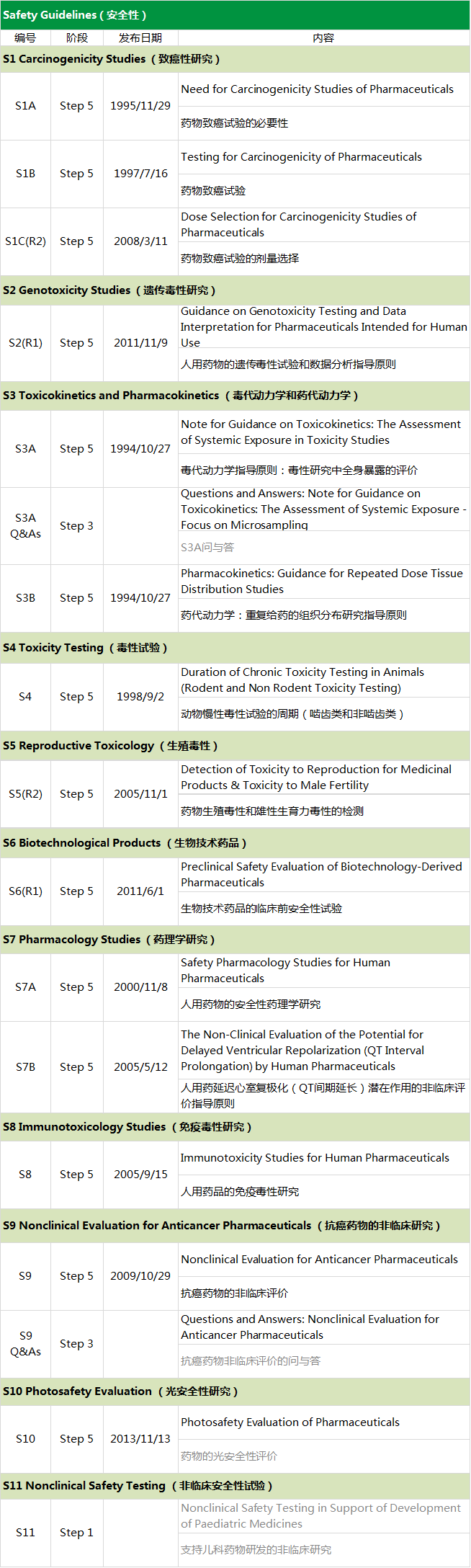
E
M



